Lehrbuch der organischen chemie für studierende an universitäten und technischen hochschulen / von dr. A.F. Holleman.
- Arnold F. Holleman
- Date:
- 1908
Licence: In copyright
Credit: Lehrbuch der organischen chemie für studierende an universitäten und technischen hochschulen / von dr. A.F. Holleman. Source: Wellcome Collection.
190/516
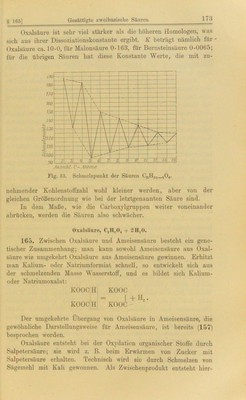
![bei Formiat, welches beim weiteren Erhitzen anter WasserstoH- entwickelung iu Oxalat übergeht. Nach dem Erkalten der Lösung wird daraus das K-Oxalat mit Wasser ausgelaugt und diese Lauge mit Kalkmilch (Calciumhydroxyd) versetzt, wodurch oxalsaurer Kalk niedergeschlagen wird, welcher mit Schwefelsäure zerlegt freie Oxal- säure liefert. Andre Bildungsweisen der Oxalsäure, welche theoretisches Inter- esse beanspruchen, sind die Einwirkung von Kohlendioxyd auf Kalium oder Natrium bei einer Temperatur von ca. 360° und die Verseifung von Cyan CN*CN (251). Oxalsäure findet sich in verschiedenen Pflanzen, vornehmlich im Sauerklee, Sauerampfer usw., als saures Kalisalz, in den meisten Pflanzen als oxalsaurer Kalk. Sie kristallisiert mit zwei Molekülen Kristallwasser, welches bereits bei ca. 30° langsam zu entweichen beginnt. Die wasserfreie Säure kann man bei vorsichtigem Erhitzen sublimieren; erhitzt man jedoch zu stark, so spaltet sie sich in COg, CO und H.,0. Die gleiche Zersetzung tritt ein, wenn eine Lösung von Uranyloxalat dem Sonnenlicht ausgesetzt wird; man nimmt dann eine lebhafte Gasentwickelung, bestehend aus CO + C02, wahr. Die gleichen Produkte entstehen beim Erhitzen mit konzentrierter Schwefelsäure. Die Geschwindigkeit dieser Zersetzung ist in hohem Maße abhängig von geringen Differenzen im Wassergehalt der kon- zentrierten Säure, und zwar liegt hier der seltene Fall vor, daß Wasser einen verzögernden Einfluß ausübt. Die Oxalsäure ist sehr leicht oxydierbar; ihre Oxydation mittels Kaliumpermanganat findet in der Maßanalyse Anwendung; ein Molekül Oxalsäure erfordert ein Atom Sauerstoff: CaHa04 + 0-2C0a + Ha0. Von den Sahen der Oxalsäure sind nur die der Alkalisalze iu Wasser löslich. Als zweibasische Säure vermag die Oxalsäure saure und neutrale Salze zu bilden. Auch sogenannte Tetraoxalate, weiche durch Vereinigung eines Moleküls sauren Salzes mit einem Molekül Säure entstehen, sind bekannt. Als solches ist das Klee- salz KHC,04-H2C204-2H.,0 zu nennen. Man kennt zahlreiche Doppelsalze der Oxalsäure; von diesen sind die meisten alkali- haltigen in Wasser löslich; man verwendet sie z. B. bei der elektro- lytischen Analyse. Unter diesen Doppelsalzen ist das Kaliumferro-oxalat K2Fe(C404)4 zu er- wähnen, dessen Lösung gelb gefärbt ist, und daher ein komplexes Ion, wahr- scheinlich [Fe(C204V] enthält, weil das Ferroion selbst seinen Lösungen schwach grüne Färbung erteilt. Dieses Salz besitzt ein starkes Reduktionsvermögeu und wird als photographischer Entwickler gebraucht. Nicht weniger wichtig ist das Kaliumferrioxalat KäFe(C204)8, das sich mit](https://iiif.wellcomecollection.org/image/b28131964_0190.jp2/full/800%2C/0/default.jpg)