Lehrbuch der organischen chemie für studierende an universitäten und technischen hochschulen / von dr. A.F. Holleman.
- Arnold F. Holleman
- Date:
- 1908
Licence: In copyright
Credit: Lehrbuch der organischen chemie für studierende an universitäten und technischen hochschulen / von dr. A.F. Holleman. Source: Wellcome Collection.
191/516
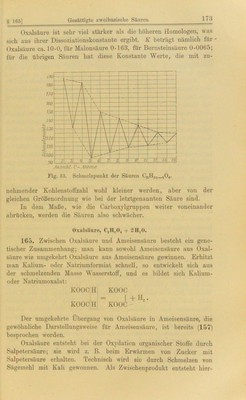
![grüner Farbe in Wasser löst und daher wahrscheinlich das komplexe Ion [FotCjO^]' enthält. Die wäßrige Lösung wird im Sonnenlicht rasch reduziert: 2K3Fe(Cä04)3 = 2K3Fe(Ci04)i + lva C., 04 + 2COj. Von dieser Eigenschaft macht man beim Platin-Lichtdruck Gebrauch. Legt man nämlich ein photographisches Negativ auf ein Papier, welches jenes Ferri- doppelsalz enthält, so erfolgt an denjenigen Stellen, wo das Licht einwirkt, Reduktion zu Ferrosalz. Taucht man nun dies Papier in eine Platinlösung, so wird das Metall nur da niedergeschlagen, wo Ferrooxalat entstanden ist. Von den Derivaten der Oxalsäure möge hier der kristallisierte Dimetkylester vom Smp. 54° Erwähnung finden, der zur Ge- winnung reinen Methylalkohols angewandt wird; man kann ihn nämlich durch Umkristallisieren leicht reinigen und dann durch Ver- seifung Methylalkohol zurückgewinnen. Der Diäthylester ist flüssig. Beide Ester erhält man leicht durch Destillieren einer Lösung von wasserfreier Oxalsäure in dem betreffenden Alkohol. Das Diamid H,NOC*CONH,, Oxamid, bildet einen in Wasser, Alkohol und Äther so gut wie unlöslichen Körper, der sich beim Zu- fügen von Ammoniak zur Lösung des Diätkvloxalates kristallinisch abscheidet. Die Monamide zweibasischer Säuren führen den Namen Amin- säuren. Das Monamid der Oxalsäure CONH.,-COOH heißt also Oxaminsäure. Dieselbe bildet eine kristallinische Masse, die in kaltem Wasser schwer, in Alkohol nicht löslich ist. Malonsäure, COjH-CH, -CO.^H. 166. Die Struktur dieser Säure ergibt sich durch ihre Synthese aus Chloressigsäure. Letztere liefert beim Kochen mit Cyaukalium Cyanessigsäure, welche beim Verseifen der Nitrilgruppe in Malon- säure übergeht: /CI _ /CN /COOH CH,-COOH ^ CH, - COOH CH,. COOH. Malonsäure ist in Wasser sehr leicht löslich (siehe Tabelle in 164). Wenig über ihren Schmelzpunkt erhitzt, gibt sie unter Bildung von Essigsäure ein Molekül CO„ ab: COOH. CH, COOH = CHg-COOH + CO,. Die Erfahrung hat gelehrt, daß alle Verbindungen, welche zwei Carboxylgruppen an demselben Kohlenstoffatom ent- halten, beim Erhitzen ein Molekül CO, abspalten. Von den Estern der Malonsäure ist vor allem Malonsäure- diäthylester von Wichtigkeit, da er zu vielen Synthesen dient. Er bildet eine Flüssigkeit von schwachem Geruch, siedet bei 198° und besitzt ein spezifisches Gewicht von 1-061 bei 15°. Bei](https://iiif.wellcomecollection.org/image/b28131964_0191.jp2/full/800%2C/0/default.jpg)